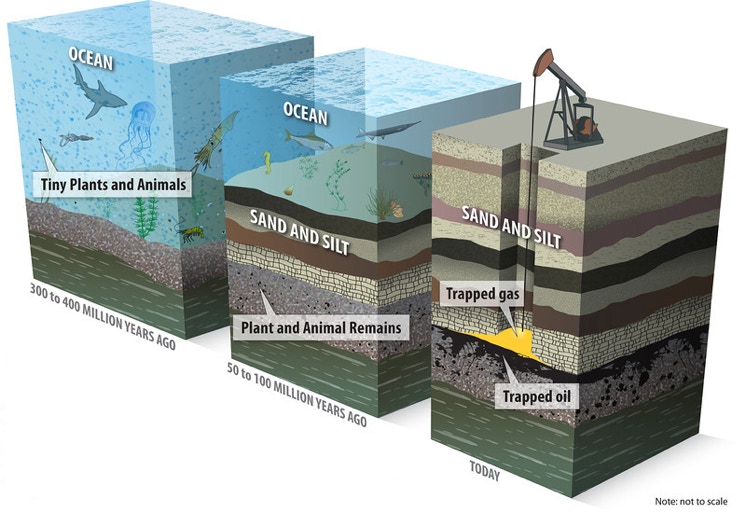
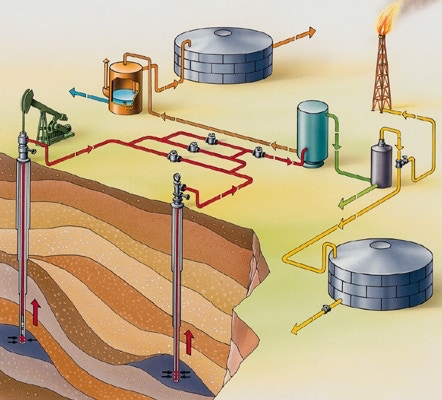
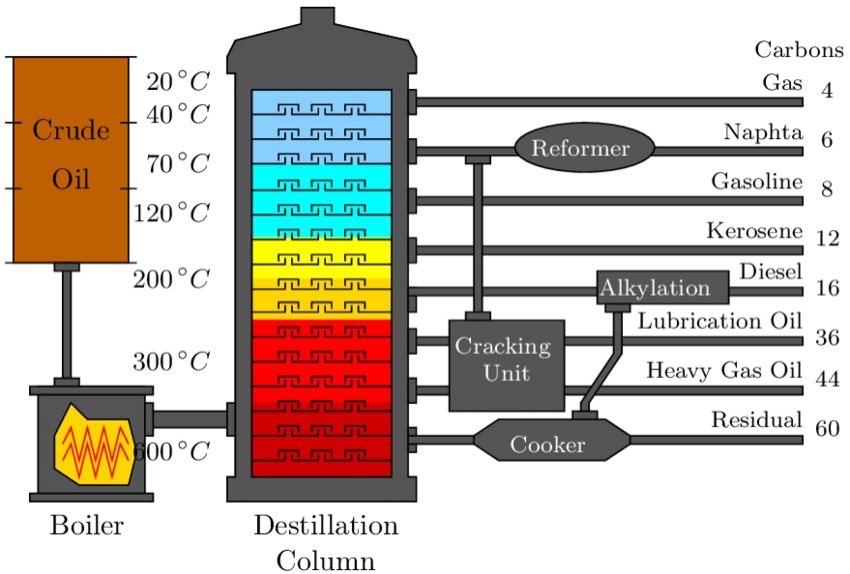
Les carburants peuvent être issus
- de la pétrochimie
- de l’agrochimie (biocarburants de 1ère et 2ème génération)
- de l’algochimie (carburant de 3ème génération)
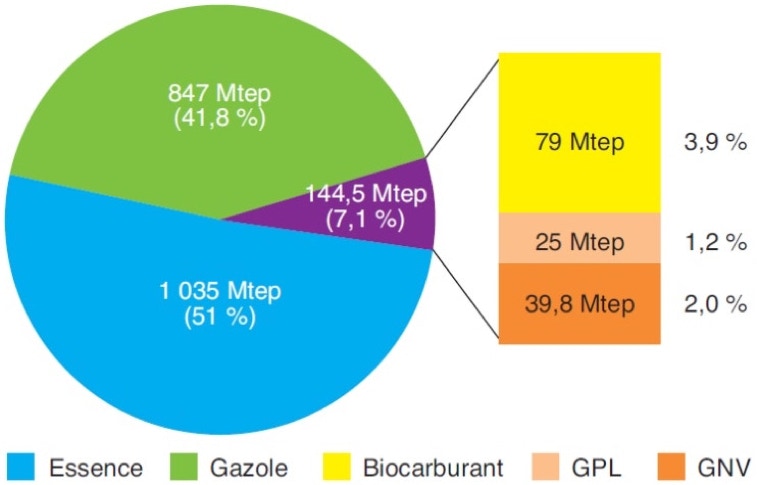
Consommation mondiale d’énergie dans les transports routiers en 2015
Le journal officiel de la République française du 19 septembre 2018 définit les deux générations de biocarburants par ː
un biocarburant de première génération est constitué d'alcools, d'huiles, d'esters d'huiles ou d'hydrocarbures qui sont obtenus après transformation de produits agricoles destinés habituellement à l'alimentation humaine ou animale (les produits agricoles utilisés proviennent notamment de plantes sucrières, amylacées ou oléagineuses).
un biocarburant de deuxième génération est constitué de composés oxygénés ou d'hydrocarbures qui sont obtenus à partir de bois, de cultures spécifiques non destinées à l'alimentation humaine ou animale, de résidus agricoles et forestiers ou de déchets ménagers.
Un moteur thermique convertit l’énergie chimique du carburant en énergie mécanique
(en passant par une libération d’énergie thermique).
La réaction chimique au coeur de cette conversion est une combustion nécessitant un apport en dioxygène et libérant de l’eau et du dioxyde de carbone.
Exemple :
équilibrer la réaction de combustion de l’heptane
Calculer les émissions de CO2, en g/km,
d’une voiture essence consommant 4,2 litres au 100 km.
On fera l’hypothèse que l’essence est intégralement constituée d’octane C8H18 de densité 0,75.
On sait que dans ce cas, le réactif limitant sera l’essence (l’air est en quantité illimitée).
Et comme tout le carbone présent dans l’octane se retrouvera dans le dioxyde de carbone
après combustion, on peut en déduire que pour chaque molécule d’octane brûlée,
8 molécules de dioxyde de carbone sont produites (dans le cas d’une combustion complète).
Il suffit donc de déterminer la quantité d’octane brûlée pour faire 1 km.
Comme le moteur consomme 4,2 L au 100 km, cela correspond à 42 mL pour 1 km.
Pour de l’eau pure, 1 mL ↔︎ 1 g,
donc pour l’essence, 1 mL ↔︎ 0,75 g.
Quantité de matière correspondante : n(octane) = m(octane)/M(octane)
La quantité de CO2 produite est 8 fois supérieure : n(CO2) = 8×n(octane)
Enfin, on détermine la masse de CO2 émise : m(CO2) = n(CO2)×M(CO2) = 97 g.
Les émissions CO2 de cette voiture sont donc de 97 g/km.
L’enthalpie de formation d’un corps composé (formé d’éléments différents) correspond à l’énergie libérée ou reçue lors de la formation d’une mole du corps à partir de corps simples (formés d’un seul élément), à la température T et sous une pression de 1 bar.
Par convention, l’enthalpie de formation d’un corps simple (dans l’état physique le plus stable à la température T sous 1 bar) est nulle.
Ainsi, à 25°C, ΔfH°(O2 (g)) = 0 J.mol-1
Une enthalpie de formation négative signifie que l’énergie est libérée par la réaction de formation.
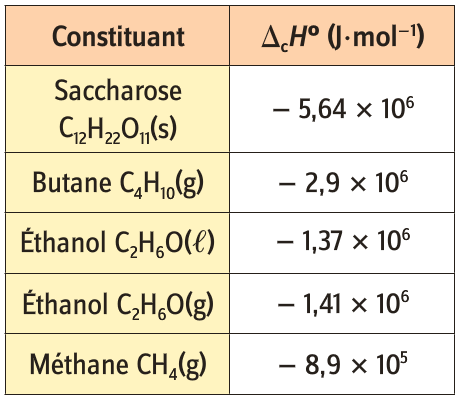
Exemples d’enthalpies de formation à 25°C sous la pression de 1 bar.
L’enthalpie de combustion est toujours négative
car ces réactions sont
L’enthalpie de combustion correspond à l’énergie thermique libérée lors de la combustion complète d’une mole du combustible avec du dioxygène, à la température T et sous une pression de 1 bar.
Exemples d’enthalpies de combustion
à 25°C sous la pression de 1 bar.
Retrouver la valeur de l’enthalpie de combustion du méthane à partir des enthalpies de formation des différents produits et réactifs (chaque constituant doit être pris dans son état standard à 25°C).
Que vaut l’enthalpie de combustion de l’heptane C7H16 ?
Lors d’une combustion, l’eau produite est sous forme vapeur (gaz).
Si elle s’échappe du système sous cette forme, que peut-on dire de l’énergie réelle fournie
par la combustion par rapport à l’enthalpie calculée ?
Bravo ! En effet, l'énergie restituée par le changement d'état gaz→liquide de la vapeur d'eau est alors perdue.
l’énergie fournie par la combustion est inférieure
à l’enthalpie calculée
Raté... Et de la même façon (voir plus loin) PCI<PCS.
l’énergie fournie par la combustion est supérieure
à l’enthalpie calculée
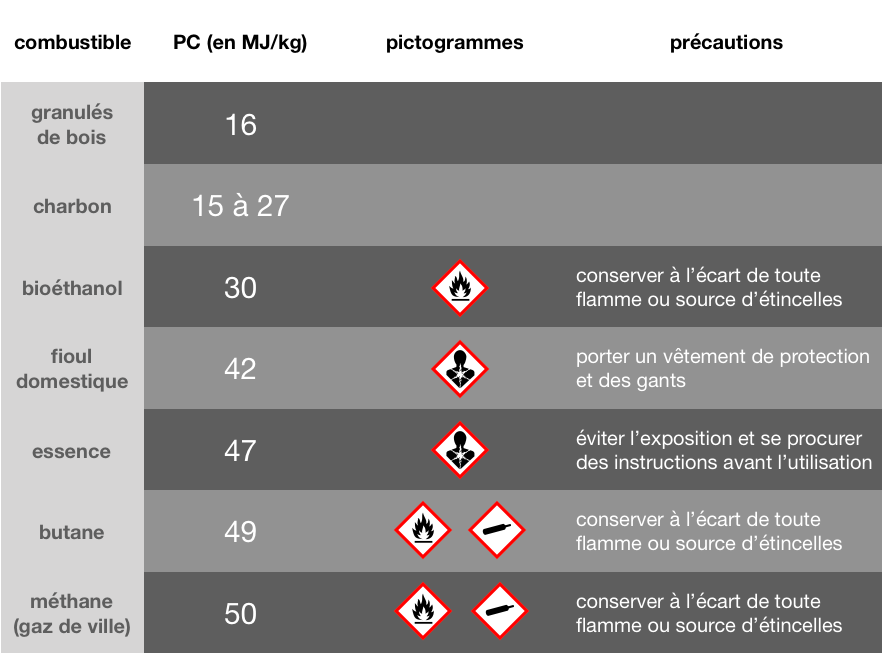
Le pouvoir calorifique PC (en J.kg-1) d’un combustible est l’énergie thermique dégagée lors de la réaction de combustion complète d’1 kg de combustible avec l’oxygène.
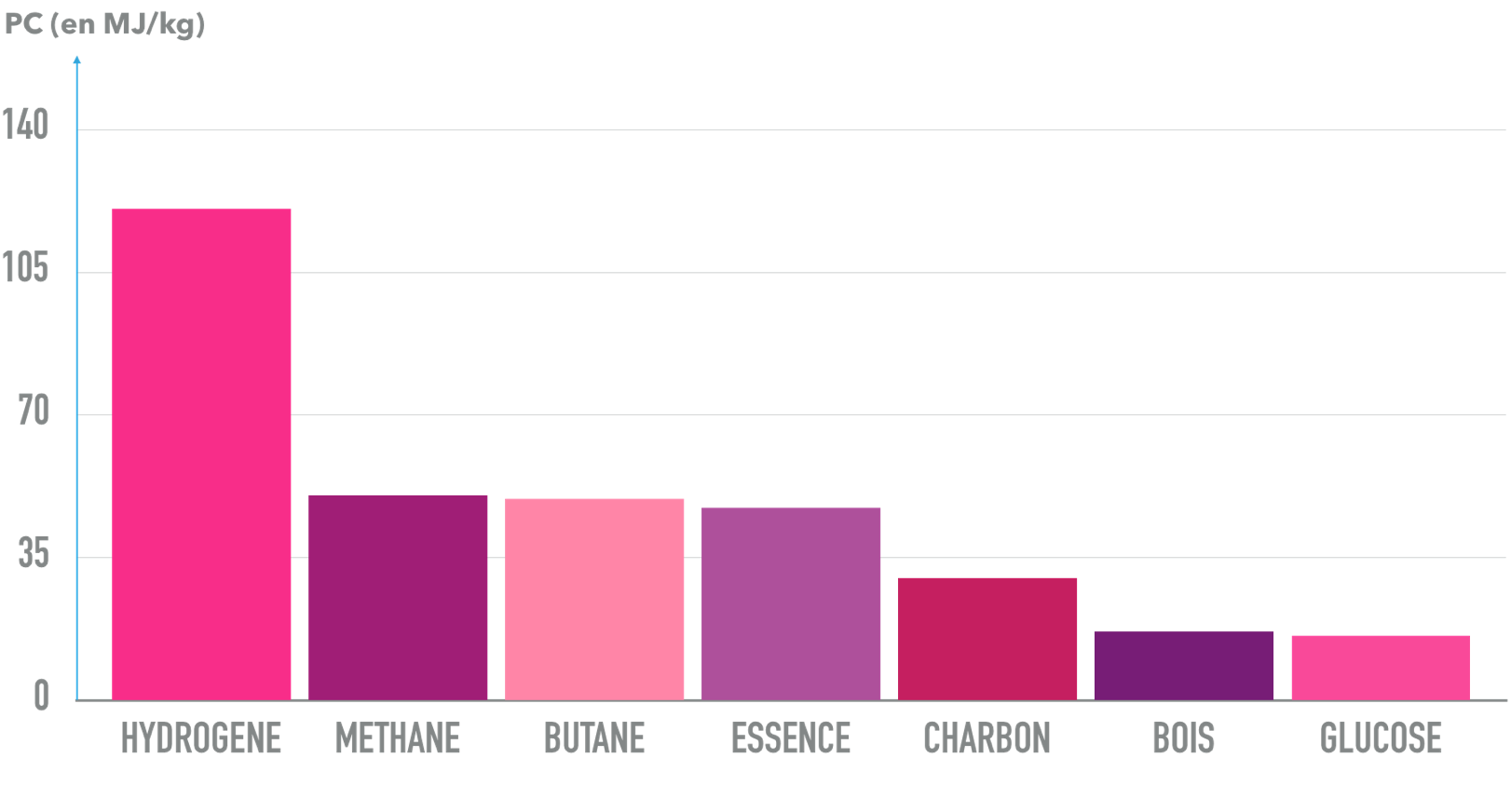
Le champion des combustibles est le dihydrogène !
En supposant que l’essence est principalement constituée d’octane (C8H18)
et sachant que l’enthalpie de combustion de l’octane vaut -5,1 MJ/mol,
retrouve-t-on bien le pouvoir calorifique de l’essence dans le tableau ci-dessus ?
à 2MJ près... Il faut dire que l'essence est en réalité loin d'être composée uniquement d'octane.
M(octane)=114g/mol donc dans 1kg, il y a m/M=8,8mol, ce qui donne 8,8×5,1≈45MJ
On distingue le pouvoir calorifique inférieur (PCI) qui ne prend pas en compte l’énergie contenue dans la vapeur d’eau produite et le pouvoir calorifique supérieur (PCS) qui la prend en compte.
La différence entre les deux correspond à l’énergie supplémentaire récupérée lors de la liquéfaction
de la vapeur d’eau produite par la combustion (PCS > PCI).
En France, c’est le plus souvent le PCI qui est utilisé pour calculer le rendement d’une chaudière. Dans ces conditions, une chaudière à condensation (qui récupère l’enthalpie de liquéfaction de la vapeur d’eau) peut-elle avoir un rendement supérieur à 100% ?
Effectivement... Ce qui prouve que c'est une erreur d'utiliser le PCI plutôt que le PCS !
Et si ! Cette chaudière fournit plus d'énergie thermique que l'énergie de combustion donnée par le PCI !
Sachant que le PCI du dihydrogène vaut 120 MJ/kg, déterminer son PCS.
1 kg de H2 correspond à 500 mol (n=m/M), et d’après l’équation de réaction (2 H2 + O2 → 2 H2O), pour 500 mol consommées de dihydrogène, il y a 500 mol d’eau produite (sous forme vapeur), soit 9 kg (n×M) de vapeur d’eau. La liquéfaction de cette masse d’eau libère une énergie m×Lv ≈ 20 MJ.
D’où un PCS d’environ 140 MJ.
Considérons une voiture de tourisme qui circule sur une route horizontale à la vitesse stabilisée de 130 km/h en mobilisant une puissance de 25 ch. Quelle distance un plein de 50 L d’essence lui permettra-t-il de parcourir ?
données : efficacité énergétique globale de la voiture = 25% (proportion de l’énergie du carburant qui sert à faire avancer la voiture = rendement aux roues), densité de l’essence d = 0,75, 1 ch = 736 W.
La puissance de 25 chevaux, soit 18 kW, que la voiture mobilise ne représente que 25% de l’énergie issue de la combustion de l’essence (à cause des multiples pertes). La puissance P produite par la combustion est donc de 72 kW.
Or les 50 L d’essence du réservoir correspondent à une masse de 50×d ≈ 38 kg, ce qui représsente un réservoir d’énergie E de 38×PC ≈ 1,8 GJ.
Comme E = P×t, l’énergie du résevoir va tenir E/P ≈ 2,5.104 s, soit 6,9 h. Et pendant ce temps, la voiture aura pu parcourir v×t ≈ 8,9.102 km soit environ 900 km.