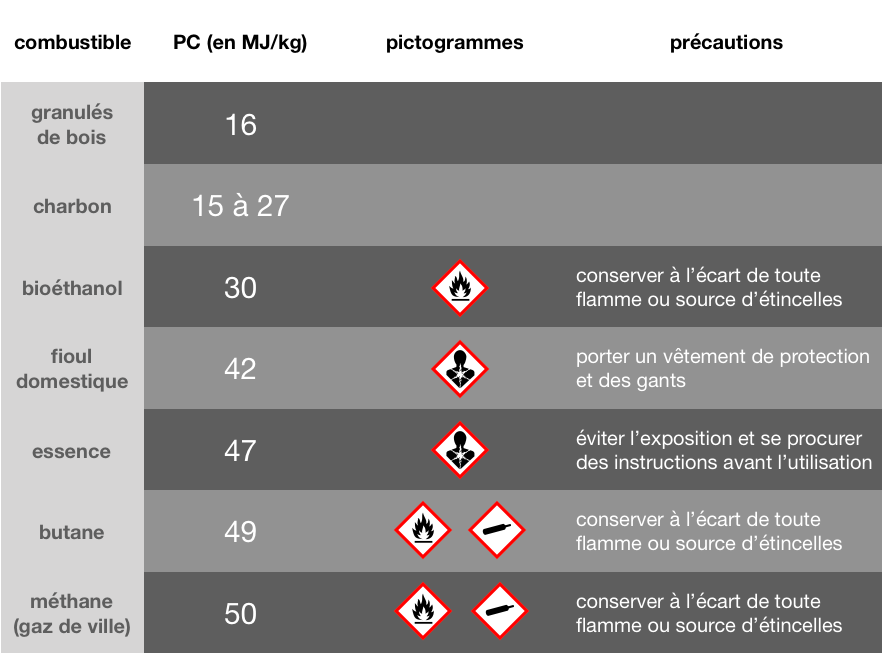
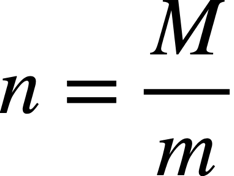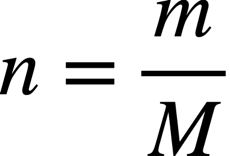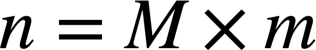Une combustion est une transformation chimique produisant de l’énergie thermique (exothermique).
Le combustible (gaz, fioul, bois,…) réagit avec le dioxygène de l’air appelé comburant.
Pour initier la transformation, il faut une source de chaleur (énergie d’activation).

Le combustible est une matière organique
(molécule à squelette carbonné issue de la vie).
Si le combustible est un hydrocarbure (molécule exclusivement composée de C et de H, comme le méthane ou le butane) ou une molécule contenant aussi des oxygènes (comme l’éthanol), les produits d’une combustion complète sont toujours le dioxyde de carbone CO2 (g) et l’eau H2O(g) sous forme de vapeur.


Remarque : dans le cas du charbon pur C(s) le seul produit de la combustion est :
😒
H2O(g)
OUI
CO2(g)
😞
O2(g)