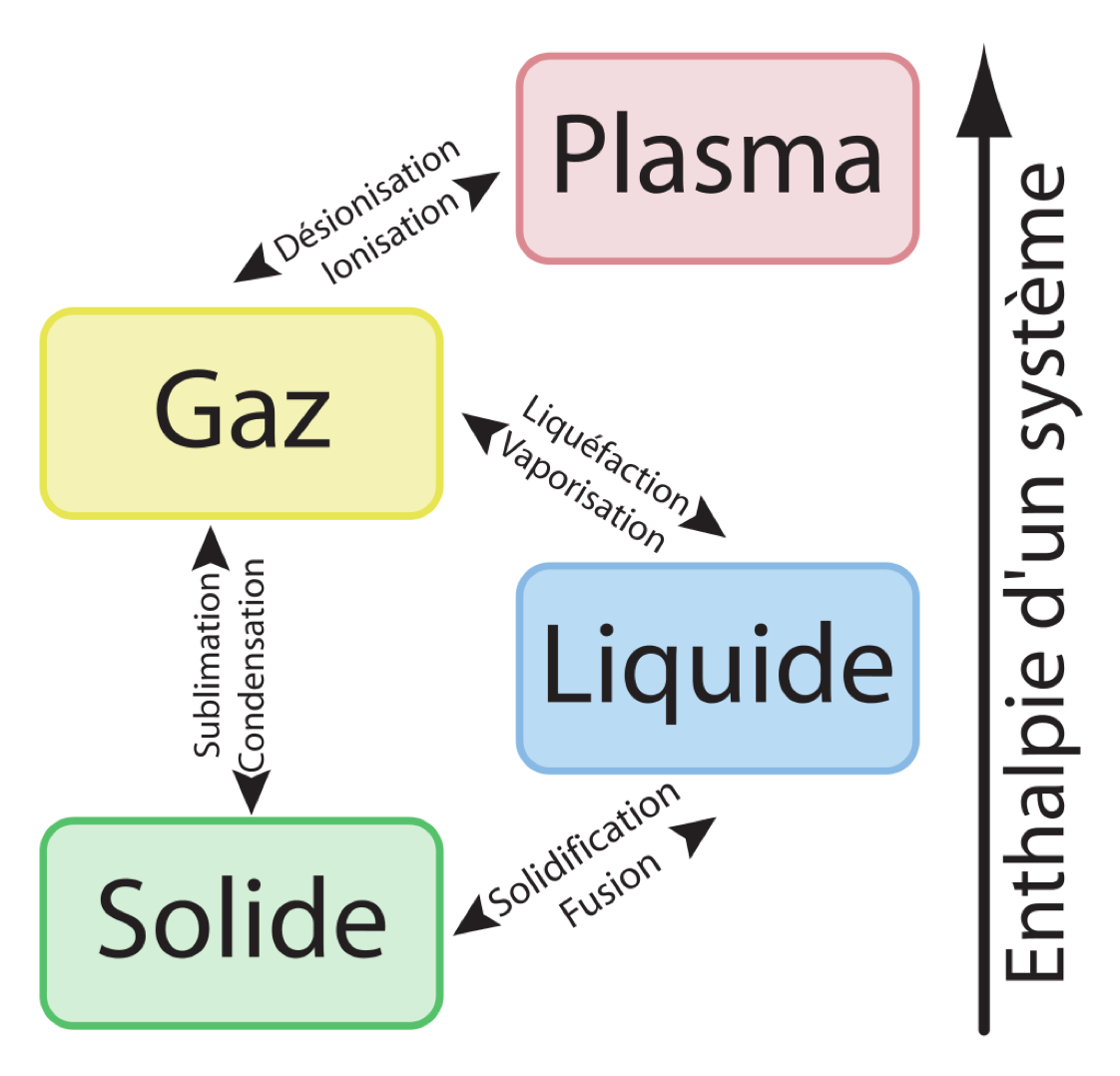
Dans le langage courant, le terme condensation désigne le passage de gazeux à liquide.

Dans le langage courant, le terme condensation désigne le passage de gazeux à liquide.
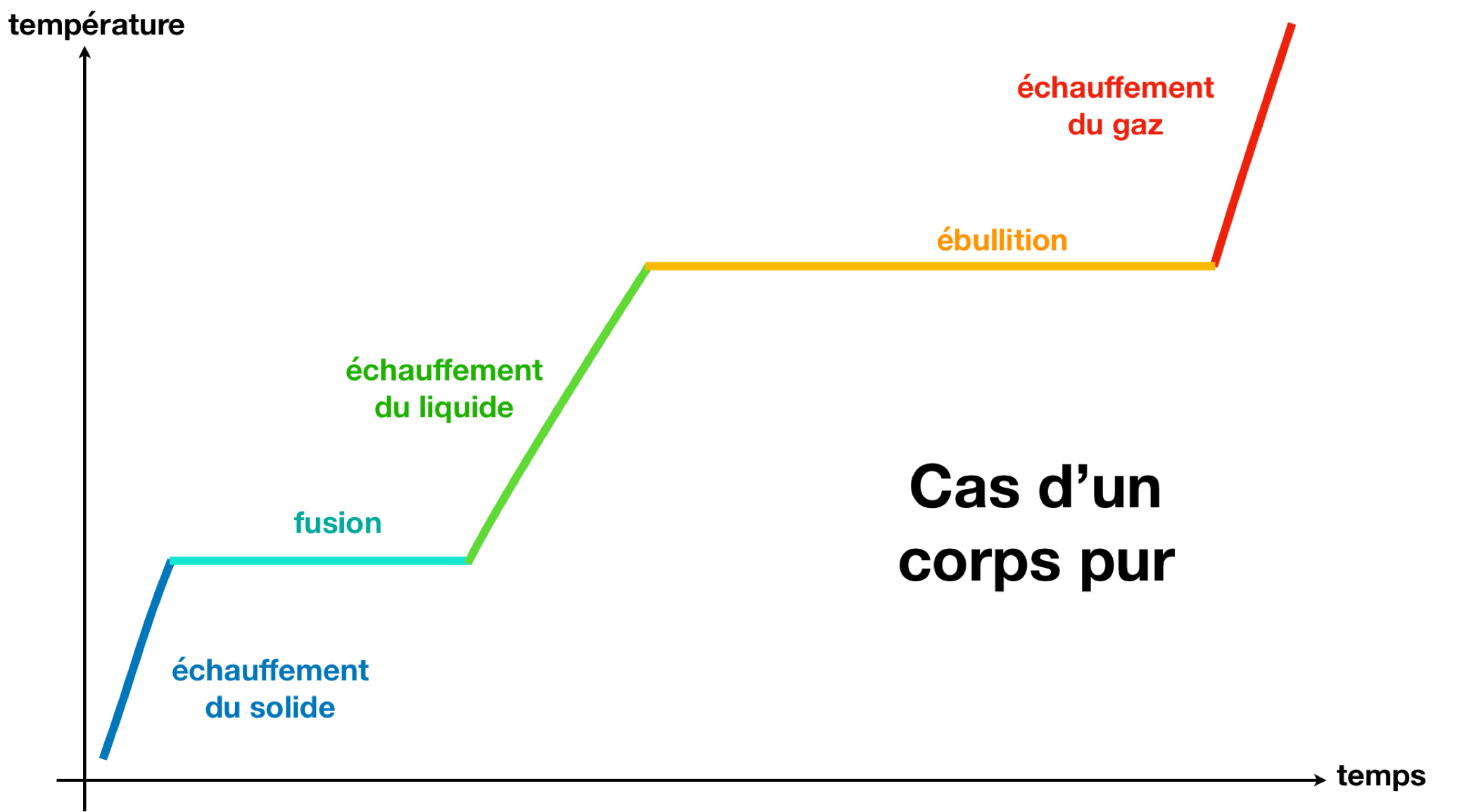
Dans le cas d’un mélange, il n’y a pas de pallier.
L’échelle Celcius de température utilise les palliers de changement d’état de l’eau à pression atmosphérique pour définir le 0 °C et le 100 °C.

Un calorimètre contient initialement ml = 400 g
d’eau à l’état liquide à θl = 20,0°C.
On y ajoute mg = 55 g d’eau à l’état solide (glaçons) à θg = -5,0°C.
On patiente alors jusqu’à l’équilibre thermique qui se fait à θf = 7,9°C.
Données :
capacité thermique massique de l’eau liquide : cl = 4,2 kJ.K-1.kg-1
La capacité thermique de la glace : cg = 2,1 kJ.K-1.kg-1
On négligera par la suite toute éventuelle fuite thermique.
Dresser le bilan énergétique
du système {eau+glaçons} dans le calorimètre
en calculant les différentes variations d’énergie interne.
Nous devrions obtenir que
la diminution de l’énergie interne des 400 g d’eau présents initialement
sert intégralement à
l’augmentation de l’énergie interne des glaçons
puis de l’eau liquide qu’ils deviennent en fondant.
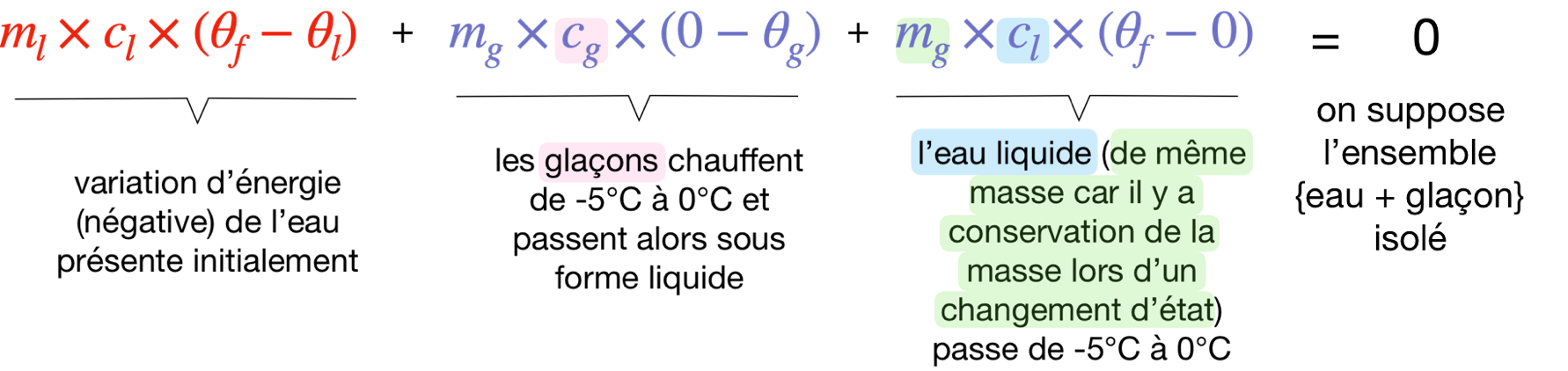
Problème : le bilan n’est pas du tout équilibré !
On trouve -20 kJ d’un côté et 2,4 kJ de l’autre…
Environ 18 kJ donnés par l’eau qui s’est refroidie n’ont pas servi à augmenter
la température du glaçon ou de l’eau froide après sa fusion. Où ont-ils bien pu passer ?
Explication :
La fusion de la glace coûte de l’énergie (et beaucoup !).
En appelant Lf cette énergie de fusion, on obtient en effet :
Lf = 18.103 / 55.10-3 = 3,3.105 J.kg-1
L’enthalpie de changement d’état ou chaleur latente correspond à l’énergie échangée par un corps pendant un changement d’état (ou transition de phase) avec son environnement. Le corps nécessite de l’énergie pour passer à un état moins lié (fusion, vaporisation) et fournit de l’énergie dans l’autre sens (solidification, liquéfaction).

Les enthalpies de changement d’état de l’eau sont particulièrement élevées :
Enthalpie de fusion Lf : 334 kJ/kg
Enthalpie de vaporisation Lv : 2265 kJ/kg
Comparer l’énergie qu’il faut pour augmenter la température d’1 L d’eau liquide de 0°C à 100°C et celle qu’il faut pour vaporiser entièrement ce litre d’eau (sans que la température ne change).
L'humidité relative de l'air 𝜑, ou degré hygrométrique, s’exprime en pourcentage
et est donné par la formule :

où Pvap est la pression partielle en vapeur d’eau de l’air et Psat est la pression en vapeur saturante (pression maximale en vapeur d’eau que l’air peut contenir à cette température).
Le point de rosée de l’air est la température à laquelle la pression partielle de vapeur d'eau est égale à sa pression de vapeur saturante. Il s'agit donc de la température à laquelle il faut refroidir un volume d'air, à pression et humidité constantes, pour qu'il devienne saturé.
Le point de rosée est un état d’équilibre : si l’air en contact d’eau liquide est au-dessus, l’eau liquide va s’évaporer jusqu’à ce que la pression de vapeur saturante soit atteinte. À l’inverse, sous le point de rosée, la vapeur d’eau de l’air se condense.
Quelle sera alors l’humidité relative de l’air d’une enceinte fermée (sans renouvellement d’air) contenant une grand quantité d’eau (comme une piscine) ?


La pression de vapeur saturante augmente avec la température jusqu’à valoir 1 bar à 100°C. Ainsi, l’eau liquide ne peut exister au-delà de 100°C à pression atmosphérique.
Quand la nuit tombe, des surfaces que le sol ne peut pas ou mal réchauffer par conduction, comme les feuilles, l’extrémité de l’herbe, les toits des voitures, perdent plus de chaleur (par rayonnement infrarouge) qu’elles n’en reçoivent et donc leur température chute. L’air à leur contact peut alors passer sous le point de rosée et comme son nom l’indique, de la rosée se dépose.

De la même manière, de l’eau se condensera sur une bouteille de soda sortie du frigo…


Dans un sauna, la température de l’air peut dépasser les 100°C
(alors que dans un hammam, elle est sous les 40°C).
Comment expliquer que le sauna soit supportable
et qu’une température plus élevée dans un hammam serait dangereuse ?
Indice : l’humidité est inférieure à 20% dans un sauna mais est de 100% dans un hammam.
Explication
On est au-dessus du point de rosée dans un sauna et la transpiration joue alors son rôle protecteur en abaissant la température de notre peau lorsqu’elle y puise une partie de son énergie pour s’évaporer (processus endothermique). À l’inverse, dans le hammam, on est sous le point de rosée, la vapeur d’eau se condense au contact de notre peau en nous donnant de l’énergie (processus exothermique).
En été, il fait plus frais sous un arbre que sous un parasol. Pourquoi ?

Réponse
L’arbre transpire par ses feuilles !
La pression de vapeur est généralement plus faible à quelques mètres de hauteur
qu’au niveau du sol et cela permet de pomper des litres d’eau des racines jusqu’aux feuilles.
Un grand chêne peut ainsi transpirer jusqu’à 150 mille litres par an.
Déduisez-en la puissance moyenne de ce climatiseur.